A. Karakteristik Atom Karbon
Kekhasan Atom Karbon
Atom karbon memiliki empat
elektron valensi. Keempat elektron valensi tersebut dapat
membentuk empat ikatan kovalen melalui penggunaan bersama pasangan
elektron dengan atom-atom lain. Atom karbon dapat berikatan
kovalen tunggal dengan empat atom hidrogen membentuk molekul metana
(CH4).
Rumus Lewisnya: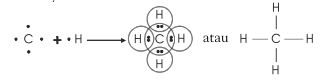 Selain
dapat berikatan dengan atom-atom lain, atom karbon dapat juga
berikatan kovalen dengan atom karbon lain, baik ikatan kovalen
tunggal maupun rangkap dua dan tiga, seperti pada etana,
etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik).
Selain
dapat berikatan dengan atom-atom lain, atom karbon dapat juga
berikatan kovalen dengan atom karbon lain, baik ikatan kovalen
tunggal maupun rangkap dua dan tiga, seperti pada etana,
etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik).
 Selain
dapat berikatan dengan atom-atom lain, atom karbon dapat juga
berikatan kovalen dengan atom karbon lain, baik ikatan kovalen
tunggal maupun rangkap dua dan tiga, seperti pada etana,
etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik).
Selain
dapat berikatan dengan atom-atom lain, atom karbon dapat juga
berikatan kovalen dengan atom karbon lain, baik ikatan kovalen
tunggal maupun rangkap dua dan tiga, seperti pada etana,
etena dan etuna (lihat pelajaran Tata Nama Senyawa Organik). Kecenderungan
atom karbon dapat berikatan dengan atom karbon lain
memungkinkan terbentuknya senyawa karbon dengan berbagai struktur
(membentuk rantai panjang atau siklik). Hal inilah yang menjadi ciri
khas atom karbon.
Kecenderungan
atom karbon dapat berikatan dengan atom karbon lain
memungkinkan terbentuknya senyawa karbon dengan berbagai struktur
(membentuk rantai panjang atau siklik). Hal inilah yang menjadi ciri
khas atom karbon. Jika
satu atom hidrogen pada metana (CH4) diganti oleh gugus –CH3 maka
akan terbentuk etana (CH3–CH3). Jika atom hidrogen pada etana diganti
oleh gugus –CH3 maka akan terbentuk propana (CH3–CH2–CH3) dan
seterusnya hingga terbentuk senyawa karbon berantai atau siklik.
Jika
satu atom hidrogen pada metana (CH4) diganti oleh gugus –CH3 maka
akan terbentuk etana (CH3–CH3). Jika atom hidrogen pada etana diganti
oleh gugus –CH3 maka akan terbentuk propana (CH3–CH2–CH3) dan
seterusnya hingga terbentuk senyawa karbon berantai atau siklik.
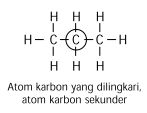
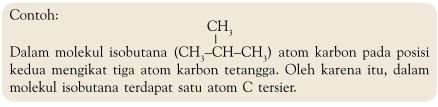
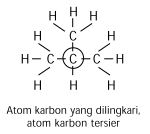
Atom C Primer, Sekunder, Tersier, dan Kuartener
Berdasarkan kemampuan atom karbon yang
dapat berikatan dengan atom karbon lain, muncul istilah atom karbon
primer, sekunder, tersier, dan kuartener. Istilah ini didasarkan pada
jumlah atom karbon yang terikat pada atom karbon tertentu.
Atom karbon primer adalah atom-atom karbon yang mengikat satu atom karbon tetangga.
Komentar : Tinggalkan sebuah Komentar »
Kategori : Kimia SMA Kelas X
Reaksi Reduksi Oksidasi (Redoks)
14 04 2010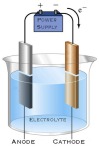 Setelah
mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan
konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama
senyawa serta penerapannya.
Setelah
mempelajari modul ini diharapkan siswa mampu menjelaskan perkembangan
konsep reaksi reduksi oksidasi dan hubungannya dengan tata nama
senyawa serta penerapannya.A. PENGERTIAN REDUKSI OKSIDASI
Pengikatan Oksigen :
Senyawa yang terbentuk dari hasil
reaksi dengan oksigen dinamakan oksida sehingga reaksi antara oksigen
dan suatu unsur dinamakan reaksi oksidasi. Karat besi adalah
senyawa yang terbentuk dari hasil reaksi antara besi dan oksigen
(besi oksida). Perkaratan besi merupakan salah satu contoh dari reaksi
oksidasi. Persamaan reaksi pembentukan oksida besi dapat ditulis
sebagai berikut.
Pada reaksi tersebut, besi mengalami
oksidasi dengan cara mengikat oksigen menjadi besi oksida. Kebalikan
dari reaksi oksidasi dinamakan reaksi reduksi. Pada reaksi reduksi
terjadi pelepasan oksigen. Besi oksida dapat direduksi dengan
cara direaksikan dengan gas hidrogen, persamaan reaksinya:
Pelepasan dan Penerimaan Elektron
Dalam konsep redoks, peristiwa
pelepasan elektron dinamakan oksidasi, sedangkan peristiwa
penerimaan elektron dinamakan reduksi. Reaksi redoks pada peristiwa
perkaratan besi dapat dijelaskan dengan reaksi berikut:
 Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh
karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada
setiap persamaan reaksi, massa dan muatan harus setara antara
ruas kanan dan ruas kiri (ingat kembali penulisan persamaan
reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah
atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan
reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Pada
reaksi tersebut, enam elektron dilepaskan oleh dua atom besi
dan diterima oleh tiga atom oksigen membentuk senyawa Fe2O3, Oleh
karena itu, peristiwa oksidasi selalu disertai peristiwa reduksi. Pada
setiap persamaan reaksi, massa dan muatan harus setara antara
ruas kanan dan ruas kiri (ingat kembali penulisan persamaan
reaksi). Persamaan reaksi redoks tersebut memiliki muatan dan jumlah
atom yang sama antara ruas sebelah kiri dan sebelah kanan persamaan
reaksi. Oksidasi besi netral melepaskan elektron yang membuatnya
kehilangan muatan. Dengan menyamakan koefisiennya maka muatan
pada kedua ruas persamaan reaksi menjadi sama. Penyetaraan pada
reaksi reduksi oksigen juga menggunakan cara yang sama.
Contoh Reaksi Reduksi Oksidasi berdasarkan Transfer elektron
 Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Dari
persamaan tersebut, dapat diketahui bahwa Mg melepaskan elektron dan Cl
menerima elektron. Dengan demikian, Mg mengalami oksidasi dan Cl
mengalami reduksi.
Reduktor dan Oksidator
Dalam reaksi redoks, pereaksi yang
dapat mengoksidasi pereaksi lain dinamakan zat pengoksidasi atau
oksidator. Sebaliknya, zat yang dapat mereduksi zat lain
dinamakan zat pereduksi atau reduktor. Pada Contoh diatas,
Magnesium melepaskan elektron yang menyebabkan klorin mengalami
reduksi. Dalam hal ini, magnesium disebut zat pereduksi atau reduktor. Sebaliknya, atom klorin berperan dalam mengoksidasi magnesium sehingga klorin disebut oksidator.
Contoh Reduktor dan Oksidator
Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Bagaimana bilangan oksidasi dapat
menjelaskan reaksi redoks? Apa Anda cukup puas dengan konsep
transfer elektron? Tinjau antara reaksi SO2 dengan O2 membentuk SO3.
Reaksinya dapat dituliskan sebagai berikut :
Jika dikaji berdasarkan konsep
pengikatan oksigen maka reaksi tersebut adalah reaksi oksidasi.
Jika dikaji berdasarkan transfer elektron maka Anda mungkin akan
bingung, mengapa? Pada reaksi tersebut tidak terjadi transfer
elektron, tetapi terjadi penggunaan bersama pasangan elektron
membentuk ikatan kovalen. Reaksi tersebut tidak dapat dijelaskan
dengan konsep transfer elektron.
Oleh karena banyak reaksi redoks yang
tidak dapat dijelaskan dengan konsep pengikatan oksigen maupun
transfer elektron maka para pakar kimia mengembangkan konsep
alternatif, yaitu perubahan bilangan oksidasi. Menurut konsep ini,
jika dalam reaksi bilangan oksidasi atom meningkat maka atom
tersebut mengalami oksidasi. Sebaliknya, jika bilangan
oksidasinya turun maka atom tersebut mengalami reduksi.
Untuk mengetahui suatu reaksi
tergolong reaksi redoks atau bukan menurut konsep perubahan bilangan
oksidasi maka perlu diketahui biloks dari setiap atom, baik dalam
pereaksi maupun hasil reaksi.
Berdasarkan diagram tersebut dapat disimpulkan bahwa:
Atom S mengalami kenaikan biloks
dari +4 menjadi +6, peristiwa ini disebut oksidasi; atom O
mengalami penurunan biloks dari 0 menjadi –2, peristiwa ini disebut
reduksi. Dengan demikian, reaksi tersebut adalah reaksi redoks.
Oleh karena molekul O2 menyebabkan
molekul SO2 teroksidasi maka molekul O2 adalah oksidator. Molekul
O2 sendiri mengalami reduksi akibat molekul SO2 sehingga SO2
disebut reduktor.
Komentar : 5 Komentar »
Kategori : Kimia SMA Kelas X
Larutan Elektrolit dan Non Elektrolit
25 01 2010
Agar
dapat memahami sifat-sifat larutan elektrolit dan non elektrolit, serta
reaksi reduksi oksidasi Anda harus mampu mengidentifikasi sifat larutan
elektrolit dan non elektrolit berdasarkan data hasil percobaan.
Materi pelajaran KIMIA Kelas X Semester 2, Oleh Gianto,SPd
GEJALA HANTARAN ARUS LISTRIK PADA LARUTAN
Arus listrik timbul karena adanya aliran elektron, yaitu suatu partikel bermuatan negatif. Elektron-elektron ini mengalir melelui suatu bahan yang disebut konduktor. Bagaimana cara mengetahui suatu cairan dapat menghantarkan arus listrik atau tidak? Untuk mengetahuinya, Silahkan lakukan percobaan Uji Daya hantar Listrik Larutan.
Materi pelajaran KIMIA Kelas X Semester 2, Oleh Gianto,SPd
GEJALA HANTARAN ARUS LISTRIK PADA LARUTAN
Arus listrik timbul karena adanya aliran elektron, yaitu suatu partikel bermuatan negatif. Elektron-elektron ini mengalir melelui suatu bahan yang disebut konduktor. Bagaimana cara mengetahui suatu cairan dapat menghantarkan arus listrik atau tidak? Untuk mengetahuinya, Silahkan lakukan percobaan Uji Daya hantar Listrik Larutan.
Materi selengkapnya (PDF)
Komentar : Tinggalkan sebuah Komentar »
Kaitkata: Larutan Elektrolit, larutan elektrolit kuat, larutan elektrolit lemah, larutan non elektrolit, senyawa ionik, senyawa kovalen
Kategori : Kimia SMA Kelas X
Hukum-hukum dasar dan perhitungan kimia
24 01 2010
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
MOL menyatakan satuan jumlah zat. Satuan jumlah zat ini sama halnya dengan penyederhanaan jumlah suatu barang. Contoh, 1 lusin digunakan untuk menyederhanakan 12 satuan barang pecah belah. Penyederhanaan ini perlu dilakukan karena proses kimia yang berlangsung dalam kehidupan sehari-hari melibatkan sekumpulan partikel sangat kecil yang jumlahnya sangat banyak.

- Hukum kekekalan massa (Hukum Lavoisier)
- Hukum perbandingan tetap (Hukum Proust)
- Hukum perbandingan volume (Hukum Gay-Lussac)
- Hukum Avogadro
MOL menyatakan satuan jumlah zat. Satuan jumlah zat ini sama halnya dengan penyederhanaan jumlah suatu barang. Contoh, 1 lusin digunakan untuk menyederhanakan 12 satuan barang pecah belah. Penyederhanaan ini perlu dilakukan karena proses kimia yang berlangsung dalam kehidupan sehari-hari melibatkan sekumpulan partikel sangat kecil yang jumlahnya sangat banyak.
Materi Selengkapnya (PDF)
Komentar : Tinggalkan sebuah Komentar »
Kaitkata: Hukum Avogadro, Hukum Gay-Lussac, Hukum Lavoisier, Hukum Proust, Konsep Mol, Massa Molar, Pereaksi Pembatas, Rumus Empiris, Rumus Molekul, Stoikhiometri, Volume Molar
Kategori : Kimia SMA Kelas X
Tata Nama Senyawa dan Persamaan Reaksi Kimia
15 11 2009
Agar
dapat memahami materi pada bagian ini, Anda harus mampu mendeskripsikan
tata nama senyawa anorganik dan organik sederhana serta persamaan
reaksinya.
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
RUMUS KIMIA
Rumus kimia menyatakan jenis dan jumlah atom dengan komposisi tertentu untuk setiap molekul. Rumus kimia sangat penting dalam mempelajari ilmu kimia karena pengertian yang utuh mengenai zat diawali dari rumus kimianya.
Persamaan yang menggambarkan terjadinya suatu reaksi kimia dinamakan persamaan reaksi, meliputi lambang dan rumus, wujud zat (padat,cair,gas,larutan), koefisien reaksi, serta tanda panah yang menunjukkan terjadinya reaksi. Dalam persamaan reaksi, zat-zat yang bereaksi terletak di sebelah kiri tanda panah (pereaksi), sedangkan zat-zat hasil reaksi terletak di sebelah kanan tanda panah (produk).
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
RUMUS KIMIA
Rumus kimia menyatakan jenis dan jumlah atom dengan komposisi tertentu untuk setiap molekul. Rumus kimia sangat penting dalam mempelajari ilmu kimia karena pengertian yang utuh mengenai zat diawali dari rumus kimianya.
- Rumus Kimia Unsur : Rumus kimia unsur terdiri atas satu atom (monoatomik) sama dengan lambang atom unsur tersebut.
- Rumus Molekul : Molekul adalah partikel penyusun senyawa. Rumus molekul adalah rumus yang menyatakan jenis dan jumlah atom yang
membentuk molekul senyawa tersebut. Rumus molekul digolongkan menjadi 2
yaitu rumus molekul unsur dan rumus molekul senyawa.
- Tata nama senyawa yang terbentuk dari unsur logam dan bukan logam.
- Tata nama senyawa yang terbentuk dari unsur-unsur bukan logam.
- Tata nama senyawa yang dibentuk oleh lebih dari dua atom yang berbeda (Poliatom).
- Tata nama senyawa Asam
- Tata nama Senyawa Basa
Persamaan yang menggambarkan terjadinya suatu reaksi kimia dinamakan persamaan reaksi, meliputi lambang dan rumus, wujud zat (padat,cair,gas,larutan), koefisien reaksi, serta tanda panah yang menunjukkan terjadinya reaksi. Dalam persamaan reaksi, zat-zat yang bereaksi terletak di sebelah kiri tanda panah (pereaksi), sedangkan zat-zat hasil reaksi terletak di sebelah kanan tanda panah (produk).
Materi Selengkapnya (PDF)
Komentar : 2 Komentar »
Kaitkata: Persamaan Reaksi Kimia, Persamaan reaksi kimia setara, Rumus Empiris, Rumus Molekul, Tata Nama Senyawa
Kategori : Kimia SMA Kelas X
Ikatan Kimia
6 10 2009
Agar
dapat memahami ikatan kimia, Anda harus mampu membandingkan proses
pembentukan ikatan ion, ikatan kovalen, ikatan koordinasi, dan ikatan
logam serta hubungannya dengan sifat fisika senyawa yang terbentuk.
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
Atom memiliki kecenderungan untuk
mencapai kestabilan dengan cara berikatan dengan atom lain. Elektron
yang berperan pada pembentukan ikatan kimia adalah elektron valensi
dari suatu atom/unsur yang terlibat. Salah satu petunjuk dalam
pembentukan ikatan kimia adalah adanya golongan unsur yang stabil yaitu
golongan VIIIA atau golongan 18 (gas mulia). Oleh sebab itu dalam
pembentukan ikatan kimia, atom-atom akan membentuk konfigurasi elektron
seperti pada unsur gas mulia.
Unsur gas mulia mempunyai elektron valensi sebanyak 8 (oktet)
kecuali Helium 2 (duplet), seperti terlihat pada table di bawah ini.| Periode | Unsur | Nomor Atom | K | L | M | N | O | P |
| 1 | He | 2 | 2 | |||||
| 2 | Ne | 10 | 2 | 8 | ||||
| 3 | Ar | 18 | 2 | 8 | 8 | |||
| 4 | Kr | 36 | 2 | 8 | 18 | 8 | ||
| 5 | Xe | 54 | 2 | 8 | 18 | 18 | 8 | |
| 6 | Rn | 86 | 2 | 8 | 18 | 32 | 18 | 8 |
Kecenderungan unsur-unsur untuk
menjadikan konfigurasi elektronnya sama seperti gas mulia terdekat
dikenal dengan istilah Aturan Oktet. Untuk mengilustrasikan ikatan
kimia dapat dilakukan dengan menuliskan rumus Lewis dan rumus ikatan.
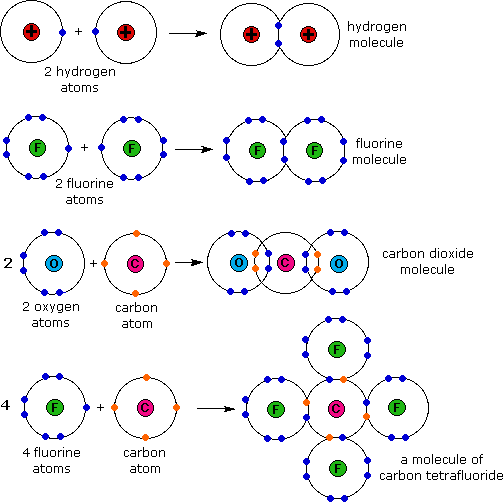
Ikatan kimia dibedakan menjadi 4 yaitu :Ikatan kovalen terdiri dari :
- Ikatan kovalen tunggal
- Ikatan kovalen rangkap dua
- Ikatan kovalen rangkap tiga
- Ikatan kovalen polar
- Ikatan kovalen non polar
Contoh Ikatan Kovalen, lihat gambar di bawah ini !
Untuk menghadapi tes atau ulangan harian tentang ikatan kimia, silahkan download soal-soal berikut ini sebagai latihan.
- Latihan soal ikatan kimia (PDF) > download
Komentar : 2 Komentar »
Kaitkata: ikatan ion, ikatan kimia, ikatan koordinasi, ikatan kovalen, ikatan logam
Kategori : Kimia SMA Kelas X
Informasi Kimia Energi Atom dan Perkembangan Model Atom
13 08 2009
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
ENERGI ATOM
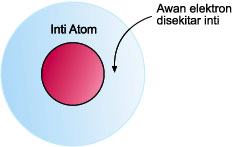
ENERGI ATOM
Energi atom adalah energi yang
bersumber dari atom. Setiap atom memiliki partikel-partikel energi.
Inti atom yang merupakan sumber energi ini dilepaskan ketika atom
terbelah.
Energi atom dapat diperoleh dengan dua
cara, yaitu dengan penyatuan atom dan pembelahan atom. Ketika dua atau
lebih atom bergabung menjadi satu, dihasilkan energi yang luar biasa
dalam bentuk panas. Sebagian besar energi matahari berasal dari reaksi
penyatuan ini.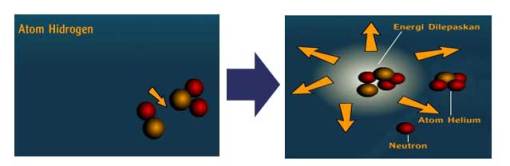

Sumber lain energi atom adalah proses
pembelahan atom. Ketika partikel-partikel atom dibenturkan dengan
partikel-partikel seperti neutron, sebagian atom akan membelah
menghasilkan energi yang luar biasa besarnya. Contohnya reaksi
pembelahan Uranium 235.
Tahukah Anda, berapa banyak energi yang
dilepaskan dari pembelahan atom di atas? Satu kilogram Uranium
menghasilkan energi sejuta kali lebih besar dibandingkan energi yang
diperoleh dari pembakaran satu kilogram batu bara ! Dan tahukah Anda
Uranium seukuran kerikil kecil dapat menjalankan sebuah kapal samudra,
pesawat, atau generator !
Kedahsyatan energi pembelahan Uranium
ini, ironisnya dikemudian hari disalahgunakan manusia untuk membuat bom
nuklir yang menewaskan jutaan manusia. Bagaimana pendapat Anda
mengenai hal ini? Sepengetahuan Anda apa saja kegunaan energi atom ini?
PERKEMBANGAN MODEL ATOM
Model atom dengan orbital lintasan
elektron ini disebut model atom modern atau model atom mekanika kuantum
yang berlaku sampai saat ini, seperti terlihat pada gambar berikut ini.

Model atom ini dikembangkan oleh Erwin
Schrodinger (1926). Bagaimanakah pendapat para ilmuwan mengenai teori
dan model ataom sebelum abad ke-19 ? Berikut ini adalah perkembangan
teori dan model atom secara kronologis yang dianggap benar menurut
zamannya. Selengkapnya (PDF) > download
Komentar : Tinggalkan sebuah Komentar »
Kaitkata: Energi Atom, Model atom Bohr, Model atom Dalton, Model atom Modern, Model Atom Rutherford, Model atom Thomson, Perkembangan Model Atom
Kategori : Kimia SMA Kelas X
Sifat-Sifat Umum Unsur dalam Sistem Periodik
13 08 2009
Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
Pada akhir abad 18 dan awal abad 19
beberapa unsur telah ditemukan dan juga diketahui sifat-sifatnya.
Unsur-unsur yang mempunyai sifat yang mirip dikelompokkan dalam satu
golongan dan dalam suata tabel yang disebut Tabel Periodik.

Beberapa sifat umum yang dimiliki unsur antara lain Jari-jari Atom, Keelektronegatifan (Elektronegativitas), Energi Ionisasi dan Afinitas Elektron. Selengkapnya (PDF) >download
Link Materi Serupa :
Beberapa Sifat Umum yang dimiliki Unsur ( Silahkan login sebagai tamu, supaya Anda bisa membaca materi ini !)
- Jari-jari atom dan jari-jari ion >Klik di sini
- Energi ionisasi (Potensial ionisasi) > Klik di sini
- Elektronegativitas > Klik di sini
- Sifat Logam > Klik di sini
- Kereaktifan > Klik di sini
Komentar : Tinggalkan sebuah Komentar »
Kaitkata: Afinitas elektron, Energi ionisasi, Jari-jari atom, keelektronegatifan, Sifat-sifat sistem periodik
Kategori : Kimia SMA Kelas X
Massa Atom Relatif dan Massa Molekul Relatif
10 08 2009 Materi Pelajaran Kimia Kelas X, Semester 1. Oleh : Gianto,SPd
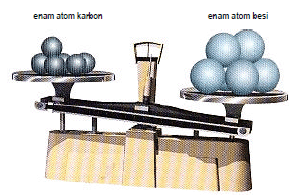
Massa atom relatif (Ar) suatu unsur adalah
perbandingan massa rata-rata satu atom unsur tersebut terhadap 1/12
masa satu atom isotop karbon-12.
Massa molekul relatif (Mr) adalah perbandingan massa satu molekul unsur atau senyawa terhadap 1/12 x massa satu atom karbon-12. Selengkapnya (PDF) > download

Massa molekul relatif (Mr) adalah perbandingan massa satu molekul unsur atau senyawa terhadap 1/12 x massa satu atom karbon-12. Selengkapnya (PDF) > download



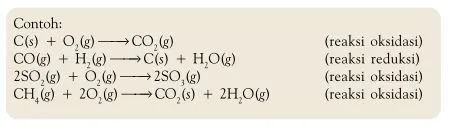

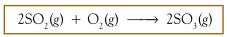


Tidak ada komentar:
Posting Komentar